摩登7平台合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
-
> 基于界面张力弛豫法考察羟基取代烷基苯磺酸盐的界面扩张流变性质(三)
> 10种常用表面活性剂水溶液的表面张力测定、泡沫的产生和测试(二)
> 考虑界面张力、液滴尺寸和液滴变形影响的携液临界模型构建(二)
> 影响铝粒进入钢液程度排序:渣铝界面张力>钢铝界面张力>钢渣界面张力
> 大庆原油表面张力测试和黏度测试实验
> 316L不锈钢粉末电子束熔化成形的熔合机制的研究(一)
> 硝化纤维素塑化效果与其表面张力的变化规律
> 乳化剂、皂液pH值、缔合型增稠剂T对乳化沥青油水界面张力和贮存稳定性的影响
> 液滴爆炸现象:酒精蒸发引起的马兰戈尼流动现象影响参数(二)
> 压力、温度、碳原子数及分子结构对CO2-正构烷烃界面张力的影响——实验结果与讨论
推荐新闻Info
-
> 影响狭缝间氢键流体气液平衡界面张力的因素有哪些(三)
> 影响狭缝间氢键流体气液平衡界面张力的因素有哪些(二)
> 影响狭缝间氢键流体气液平衡界面张力的因素有哪些(一)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(四)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(三)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(二)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(一)
> 表面张力实验、接触角实验分析抑尘试剂对煤的润湿结果
> 摩登7表面张力仪研究烧结矿聚结行为
> 基于界面张力和表面张力测试评估商用UV油墨对不同承印纸张的表面浸润性差异(三)
应用单分子层技术分析磷脂酶与不同磷脂底物特异水解性能:摘要、介绍、材料和方法
来源:上海谓载 浏览 1521 次 发布时间:2022-02-14
摘要
底物特异性是表征酶的一个关键参数,它直接关系到酶的应用潜力。商品化的Lecitase Ultra已被广泛用于石油脱胶过程中,以特异性水解原油中的磷脂,但其对各种磷脂的特异性仍不清楚。在本研究中,采用单层技术,在不同的表面压力条件下表征了超乳糖酸酶对不同种类磷脂的选择性。超乳糖酸酶对各种磷脂的水解活性高度依赖于单层膜的表面压力。在相同的表面压力(25mN/m)下,在所有磷脂单层膜的液体冷凝状态下,超卵磷脂酶对不同单分子磷脂膜的偏好顺序为PE>CL>PS>PI>PC。在测试的表面压力范围内,未观察到鞘磷脂的水解活性。目前的研究提供了关于Lecitase Ultra对各种磷脂的选择性偏好顺序的基本信息,这是以前未知的,并为更好地利用这种酶在石油工业中提供了额外的信息。
实际应用
据我们所知,我们已经报道了应用单层技术研究超乳糖酸酶对各种天然磷脂的底物选择性。这项研究直接有助于该酶在工业中的应用。此外,我们试图证明单层技术对于评估某些天然底物的酶活性是非常有效和简单的,并且应该在界面酶工程领域做出更大的贡献。
图形摘要
利用单层技术表征超乳糖酸酶对不同磷脂的界面催化性能。
1、介绍
Lecitase Ultra是蓝绿假单胞菌脂肪酶(TLL)和尖孢镰刀菌脂肪酶(FOL)的嵌合体[1],具有相当高的磷脂酶活性和脂肪酶活性[2]。这种酶完全基于其磷脂酶活性,能够水解油中的磷脂,并通过形成溶血磷脂和甘油磷脂将其去除,从而成功地用于植物油的脱胶[3,4]。正如我们所知,不同来源的原油中磷脂的组成和含量存在显着差异:例如,原油中的卵磷脂通常含有20%的磷脂酰胆碱(PC)、15%的磷脂酰乙醇胺(PE)、20%的磷脂酰肌醇(PI)、5%的磷脂酸(PA)和其他磷脂[5]。因此,Lecitase Ultra对不同磷脂的选择性是实际应用中的一个重要参考指标,这反过来又与应添加的酶量以及脱胶过程中所需的反应时间直接相关。因此,获得这种酶对天然磷脂的选择性信息尤为重要。然而,仍然缺乏对这方面的深入了解。
脂肪酶作为一种界面酶,催化不溶性底物与水之间的界面水解反应[6]。因此,脂肪分解的催化反应与各种界面现象有关,并强烈依赖于界面上存在的脂质基质的结构组织[6-8]。为了获得有关酶对各种磷脂选择性的适当信息,选择合适的测试方法至关重要,应该是首要考虑的问题。
单层技术是研究空气/水界面上酶-脂质相互作用的最通用的实验系统,已被用于通过相对表面活性来比较脂肪酶的底物选择性[9]。使用单层技术进行酶表征有几个优点。首先,底物和酶只需要少量的物质。因此,我们可以以非常低的成本获得酶的活性信息。其次,可以改变表面组分的分子堆积,并且可以连续监测脂质或蛋白质从界面的释放或转移到界面的情况。第三,与传统的pH-stat方法相比,该方法的高灵敏度已通过实验得到验证[10,11]。最后,反应的物理化学参数,如温度、侧压、分子密度、离子条件等,可以在很宽的范围内方便地改变,并且可以以Å精度分析结构[12]。因此,单分子层是研究界面酶反应的合适模型。到目前为止,不同种类的脂肪酶,甚至磷脂酶(包括磷脂酶A2、C和D)已经通过使用这种方法进行了表征[11-14]。
本文首次采用单层技术对商品化超乳糖酸酶的底物选择性进行了表征。目前的结果不仅提供了对酶底物选择性的透彻理解,而且为酶在石油工业中的具体用途提供了详细信息。
2、材料和方法
2.1材料
商业Lecitase Ultra由丹麦巴格斯瓦尔德诺维信A/S提供,直接测试,无需进一步纯化。L-α-磷脂酰肌醇(PI,纯度≥1,2-二酰基-sn-甘油-3-磷酸-L-丝氨酸(PS,纯度≥97%),L-α-磷脂酰乙醇胺(PE,纯度≥1,2-二油基-sn-甘油-3-磷酸胆碱(PC,纯度≥97%),心磷脂(CL,纯度)≥鞘磷脂(SM,纯度)≥98%)和β-环糊精从Sigma-Aldrich(密苏里州圣路易斯)购买。HPLC级氯仿购自凯美尔化学试剂有限公司(天津)。使用Millipore(马萨诸塞州贝德福德)Milli-Q水系统净化水。所有其他摄政王都是分析级的。
2.2单分子薄膜实验
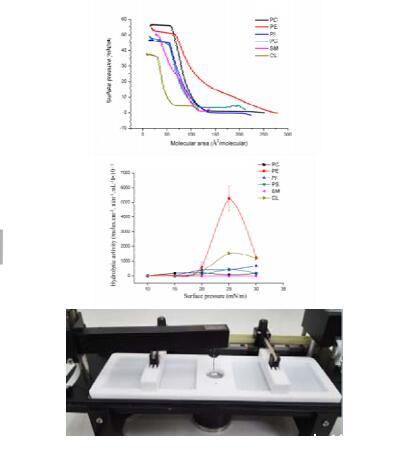
2.2.1表面压力-面积等温线
使用带有Langmuir-Teflon槽(206 mm×59 mm)的商用单层系统(赫尔辛基摩登7的微槽X)和两个屏障的对称压缩,记录不同磷脂单层的压缩等温线。实验在室温(25℃)下进行。通过使用microsyringe(Hamilton Co.,Reno,NV)将不同磷脂的氯仿储备溶液滴在50 mM柠檬酸缓冲液(pH 5.0)亚相上形成单层(Hamilton Co.,Reno,NV)。15分钟后,以2.5 mm/min的速率连续压缩所需组合物的单层。表面压力是用附着在表面的金属丝探针测量的。连续记录表面压力与表面积(π-A)等温线。只要需要,胶片就被压缩到崩溃压力。每次运行重复三次,保持π-A等温线的标准偏差小于4Å2。
2.2.2使用一个"零级"槽(由一个圆形反应室和两个储液室(182mm×40mm)组成)进行了Lecitase Ultra的动力学水解活性计算。反应室的直径为21 mm,面积为346 mm2。这两种隔室通过一个小的表面通道(宽0.5厘米)相互连接。该方法的原理之前由Verger和De Haas[15]描述。在目前的工作中,用毫Q水制备50 mM柠檬酸缓冲液(pH 5.0),并通过0.45μm微孔膜过滤。在50 mM柠檬酸缓冲液(pH 5.0)亚相上涂抹几微升氯仿磷脂溶液,直到达到所需的初始表面压力(πi),制备单层。由恒压器自动驱动的移动式屏障在储层上来回移动,以压缩并保持表面压力(π)恒定。为了确保水解反应中产生的长链脂肪酸能够溶解在水中,按照Mosbah等人的建议,将β-环糊精(0.6 mg/ml)注入反应室。[10]。然后将10μL酶溶液注入反应室的亚相以开始反应。如前所述,对数据进行了相应的分析[15,16]。活性显示为单位时间、单位反应室面积和"零级"槽中每毫升酶水解的底物摩尔数(摩尔数cm-2.min-1.mL-1)。所有分析测定均一式三份进行。结果以平均标准偏差(SD)的形式清楚地呈现。










