摩登7平台合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
推荐新闻Info
-
> 影响狭缝间氢键流体气液平衡界面张力的因素有哪些(三)
> 影响狭缝间氢键流体气液平衡界面张力的因素有哪些(二)
> 影响狭缝间氢键流体气液平衡界面张力的因素有哪些(一)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(四)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(三)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(二)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(一)
> 表面张力实验、接触角实验分析抑尘试剂对煤的润湿结果
> 摩登7表面张力仪研究烧结矿聚结行为
> 基于界面张力和表面张力测试评估商用UV油墨对不同承印纸张的表面浸润性差异(三)
GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(三)
来源:食品科学 浏览 37 次 发布时间:2025-04-17
2结果与分析
2.1单一乳液特性结果
2.1.1单一乳液的粒径分布
乳液粒径大小是评价乳液物理特性的重要指标之一,可判断乳化剂的乳化活性。在脂肪消化过程中,乳液的比表面积决定了胆盐、脂肪酶在油-水界面的吸附位点,因此乳液粒径大小对脂肪消化速率影响显著。如图1所示,10%GA、1%WPI和0.2%T80制备乳液的粒径分布基本一致,可保证乳液液滴的比表面积一致,消除乳液粒径对脂肪消化速率造成的影响。后续实验均采用此乳化剂质量分数。
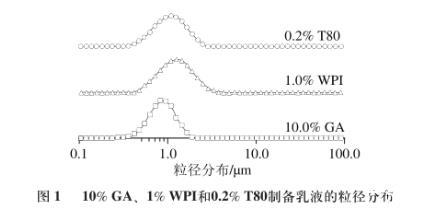
图1 10%GA、1%WPI和0.2%T80制备乳液的粒径分布
2.1.2单一乳液的消化动力学
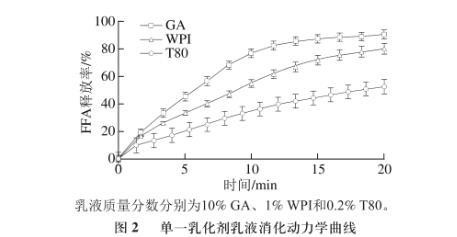
图2单一乳化剂乳液消化动力学曲线
由图2可知,GA乳液的脂肪消化速率最大,其次为WPI,T80乳液的脂肪消化速率最低。由于GA是大分子链状多糖,分子中的阿拉伯半乳聚糖蛋白(arabinogalactan protein,AGP)约含12%,是主要的提供界面活性的部分。AGP中的疏水蛋白部分吸附在界面上,外凸的亲水多糖链部分则提供了空间斥力来抑制乳液颗粒的絮凝和聚集。GA分子中仅有小部分吸附在乳滴界面上,吸附位点少而弱,在模拟肠液中极易被胆盐取代。WPI是球形蛋白质分子,可凭借分子中疏水基团全部吸附在界面上,且蛋白质分子能与胆盐结合,限制胆盐的活动能力,从而降低了消化速率。T80为小分子表面活性剂,可吸附在脂滴界面上形成整齐致密的界面结构,因此可有效阻碍胆盐和脂肪酶在界面上的吸附。
2.1.3单一乳液的界面流变特性
由图3A可知,GA和WPI界面的弹性模量值基本一致,比T80界面的弹性模量值高很多。说明此质量分数条件下GA和WPI形成的界面相对T80有更好的界面黏弹性。这是由于大分子GA和WPI具有较强的空间位阻,在乳滴界面可形成较厚的吸附层,乳滴空间稳定性较好,可在一定程度上抵御外力造成的变形。T80属于小分子表面活性剂,在界面吸附致密整齐,但乳滴的空间稳定性较差,易发生变形和聚集。图3B表明,在加入胆盐后,GA界面的界面张力降低值ΔT为8.42 mN/m,T80界面的界面张力基本不变,WPI界面的界面张力降低值ΔT为1.09 mN/m,由此证明T80的抗胆盐取代能力最优,其次为WPI和GA。3种乳化剂所呈现的界面特性与3种乳液的消化动力学规律相吻合。采用界面流变技术可有效评价乳化剂的界面特性,肠液组分对乳滴界面特性造成的影响以胆盐取代最为显著。因此,通过评价胆盐在界面的取代能力,可在一定程度上判断乳液的脂肪消化动力学规律。
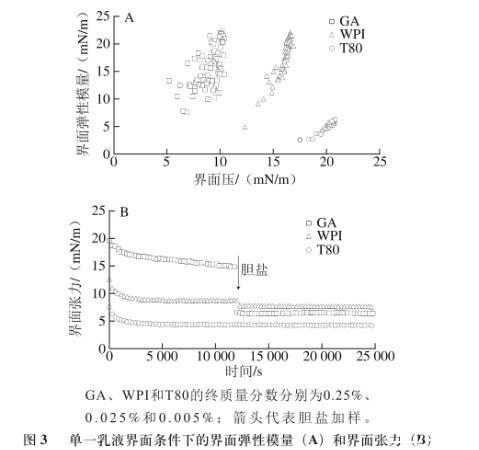
图3单一乳液界面条件下的界面弹性模量(A)和界面张力(B)
2.2复合乳液特性结果
2.2.1复合乳液的粒径分布
采用大分子GA或WPI与小分子表面活性剂T80设计大分子和小分子复合乳液界面,通过不同的乳液制备方法,调控界面结构组成,以此来评价复合乳液界面对脂肪消化速率的影响。前期研究表明,采用逐层添加的方法制备乳液,二次添加的乳化剂为原位吸附,不会影响到初始乳液的粒径。因此,采用具有相同粒径分布的单一乳化剂质量分数制备逐层吸附或混合吸附乳液,其粒径分布可保持一致。
2.2.2 GA和T80复合乳液
由图4可知,采用GA乳化均质再添加T80吸附的乳液(GA-T80),其消化动力学曲线出现明显的延滞期和加速期。而采用T80乳化均质再添加GA吸附的乳液(T80-GA)以及将GA和T80混合后乳化均质制备的乳液(GA+T80),其乳液消化动力学曲线与GA-T80乳液消化曲线中的延滞期速率相重合,乳液的FFA释放程度依次为GA-T80>GA+T80>T80-GA。研究表明,在多糖或蛋白乳液中加入非离子型表面活性剂,会出现消化动力学曲线的延滞期和加速期,推测脂肪酶在乳滴界面的吸附需要一定的时间是造成延滞期的主要原因。而T80-GA乳液和GA+T80乳液具有和GA-T80乳液类似的延滞期,是由其界面结构所决定的。
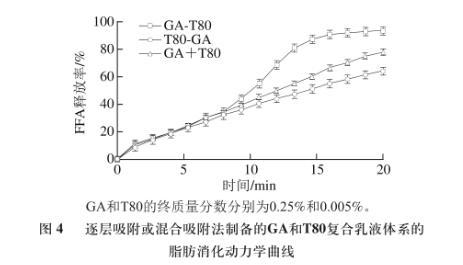
图4逐层吸附或混合吸附法制备的GA和T80复合乳液体系的脂肪消化动力学曲线
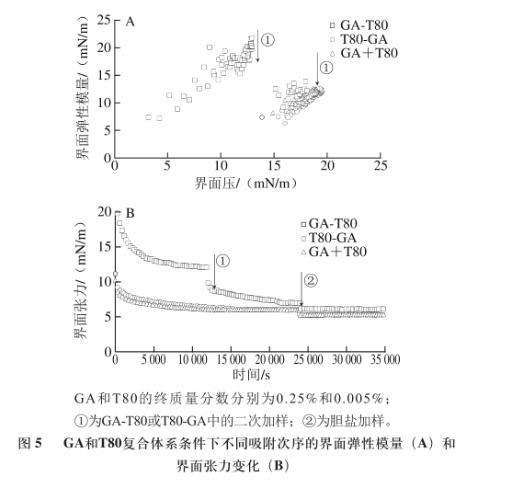
图5 GA和T80复合体系条件下不同吸附次序的界面弹性模量(A)和界面张力变化(B)
如图5A所示,GA-T80体系的界面弹性模量值在加入T80后明显下降,但略高于GA+T80和T80-GA两种体系条件下的界面弹性模量值。T80-GA体系的界面弹性模量在加入GA后未发生任何变化,与GA+T80体系的界面弹性模量值基本一致。由图5B可知,GA-T80体系条件下的界面张力值在加入T80后大幅度降低,加入胆盐后也有一定程度的降低(ΔT约为0.91 mN/m)。T80-GA体系的界面张力值在加入GA后未发生变化,与GA+T80体系的界面张力值几乎完全重合,2种体系在加入胆盐后界面张力值下降程度一致(ΔT约为0.74 mN/m)。由此可推测,GA-T80体系中T80取代了界面上部分GA,形成了GA/T80的混合吸附界面。GA+T80和T80-GA两种体系的界面结构相似,可能为T80主导的界面结构。T80主导的界面结构其抗胆盐取代能力优于GA/T80的混合吸附界面。
对于GA-T80体系,由于GA是链状大分子多糖,仅AGP中的疏水蛋白部分吸附在界面,界面结构较为松散。小分子表面活性剂T80能够填补界面上GA分子间空隙或取代部分GA,形成较为致密的界面结构。对于T80-GA体系,由于T80优越的乳化活性,T80可在界面上整齐排列形成致密界面结构,GA难以找到界面吸附位点,也无法取代已在界面吸附平衡的T80,因此形成以T80主导的界面结构。对于GA+T80体系,将二者共同加入后,GA和T80在界面上竞争性吸附,GA的界面吸附位点较少,乳化活性显著低于T80,难以在界面占据,因此也形成了以T80主导的界面结构。界面上的T80在一定程度上阻碍或延缓了脂肪酶吸附,即脂肪酶的吸附需耗费一定时间,酶解反应无法立即启动。因此3种乳液的脂肪消化动力学曲线中均出现了延滞期。不同的是,GA-T80乳液界面为GA和T80共同吸附,与T80相比,GA较易被胆盐取代而使脂肪酶吸附,因此在GA-T80乳液的延滞期后会出现加速期。而以T80为主导的乳液界面,测定时间内未见到明显的加速期。










