摩登7平台合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
-
> 可视化实验方法研究电场作用下液滴撞击表面的动态行为(一)
> 连铸结晶器内渣钢两相表面张力和界面张力的演变行为与机制
> 起泡剂作用下单气泡运动特性实验研究
> 水面上单分子层膜通过磷脂光控开关实现可逆光学控制——结果与讨论
> 筛选常用、经济且可抑制低阶煤煤尘的表面活性剂(二)
> 光滑粒子流体动力学新方法及应用
> 用吸管往水里吹气,为什么水里的气泡不像气球一样越吹越大?而是分成很多个连续的小气泡冒出来?
> 新研究的海水基耐高温驱油压裂液界面张力值等性能优于常规驱油压裂液产品
> SAW作用下的液膜铺展实验:引入活性剂浓度对分离压和表面张力的影响
> 柴油机尾气颗粒物采样滤纸称重设计,有效缩短微量天平的稳定时间
推荐新闻Info
-
> 影响狭缝间氢键流体气液平衡界面张力的因素有哪些(三)
> 影响狭缝间氢键流体气液平衡界面张力的因素有哪些(二)
> 影响狭缝间氢键流体气液平衡界面张力的因素有哪些(一)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(四)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(三)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(二)
> GA、WPI和T80复合乳液体系的脂肪消化动力学曲线、界面张力变化(一)
> 表面张力实验、接触角实验分析抑尘试剂对煤的润湿结果
> 摩登7表面张力仪研究烧结矿聚结行为
> 基于界面张力和表面张力测试评估商用UV油墨对不同承印纸张的表面浸润性差异(三)
LB膜分析仪应用:不同初始表面压力条件对VhPLD的磷脂吸附亲和力影响(二)
来源:中国油脂 浏览 972 次 发布时间:2024-07-03
2.2 VhPLD对不同磷脂单分子层的吸附动力学参数
单分子层最适合用来模拟细胞膜结构,基于此模型不仅可以研究界面酶分解脂质的动力学,还可以通过跟踪脂质分子面积的变化来研究蛋白质在磷脂单分子层上的吸附动力学,其中脂质分子面积的变化直接由界面表面压力的增加值(ΔΠ)进行精确监测[11-12]。磷脂分子是两亲性结构,由疏水性的酰基链尾端和一个极性头所组成。当含有磷脂的氯仿溶液滴加到水相表面时,随着氯仿有机溶剂的挥发,磷脂分子自然铺展开来,随即形成磷脂单分子层膜。单分子层技术正是基于该原理进行单分子层的制备,同时,利用高灵敏度探针精确测量磷脂单分子层的表面压力变化。选取常见的几种磷脂(PC、PE、PS、PG和PI),测量VhPLD对不同磷脂的吸附动力学参数。同时,尝试比较不同初始表面压力条件下,酶蛋白吸附动力学参数的变化。对于不同的磷脂单分子层,选定的蛋白浓度范围为10~250 nmol/L,在不同的Πi下进行一系列的吸附动力学测定。
2.2.1单一初始表面压力条件下VhPLD对不同磷脂单分子层膜的吸附动力学参数
由于膜组分通常形成水不溶性单分子层,因此膜表面浓度被定义为单位面积上界面的物质量。膜表面压力π被定义为水相表面张力(γ0)与薄膜覆盖表面的表面张力(γf)之差,其中γ0为72.8 mN/m[13]。表面压力是表征磷脂单分子层的一个重要的参数。Boisselier等[14]提出影响蛋白与脂质单分子层结合的因素有很多,如下相中缓冲液的组成、脂质膜的性质、蛋白的性质等。
在初始表面压力为15 mN/m的条件下(见图2),VhPLD对PC、PE、PS、PG和PI的吸附常数分别为(1.19±0.02)×104、(6.69±0.55)×103、(8.51±0.93)×103、(3.59±0.17)×103、(2.89±0.35)×103mol/(L·s)。VhPLD对不同磷脂单分子层膜的吸附常数之间存在显著性差异(P<0.05),其中,吸附常数最大值出现在PC,最小值出现在PI。吸附常数值越大,表明酶蛋白越容易吸附到磷脂质-水界面上。VhPLD对PC、PE、PS的解离常数分别为(2.99±0.20)×10-3、(3.67±0.50)×10-3、(3.82±0.81)×10-3s-1,统计学分析表明3组数据之间无显著性差异(P>0.05)。而VhPLD对于PG和PI的解离常数分别为(1.17±0.24)×10-3s-1和(1.77±0.48)×10-3s-1,统计学分析表明2组数据之间无显著性差异(P>0.05)。然而,VhPLD对PC、PE和PS的解离常数与对PG和PI的解离常数之间存在显著性差异(P<0.05)。解离常数越小,表明酶蛋白与磷脂结合越紧密,不容易从界面上解离下来,反之,表明酶蛋白越容易与磷脂分离。在初始表面压力15 mN/m条件下,该酶对PC具有最大的吸附平衡常数((3.98±0.01)×106mol/L),其次是PG((3.07±0.15)×106mol/L),相反地,对于PE和PI的吸附平衡常数仅为(1.82±0.15)×106mol/L和(1.63±0.20)×106mol/L。吸附平衡常数反映的是酶对磷脂的亲和力(或者是偏好性)大小,吸附平衡常数值越大,表明酶对磷脂的亲和力越大,反之,亲和力越小。以上结果表明,在初始表面压力为15 mN/m的条件下,VhPLD对PC的亲和力最强,而对于PE和PI的亲和力最弱。在初始表面压力15 mN/m条件下,VhPLD对不同磷脂单分子层吸附偏好性顺序为PC>PG>PS>PE=PI。
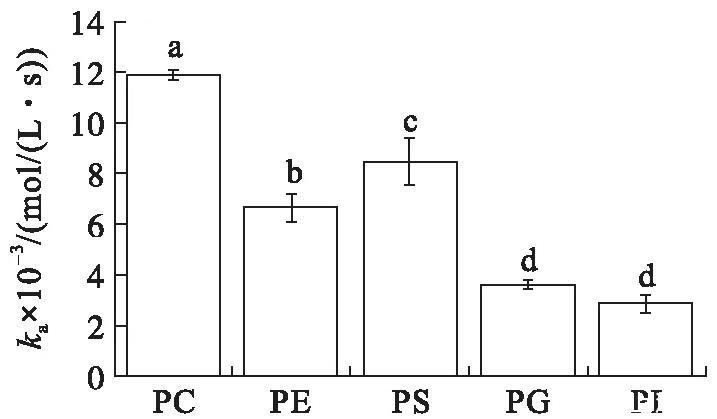
图2初始表面压力15 mN/m的条件下VhPLD对PC、PE、PS、PG和PI的吸附动力学参数
在初始表面压力为20 mN/m条件下(见图3),与VhPLD在初始表面压力为15 mN/m条件下对不同磷脂的吸附常数趋势相同,VhPLD对PC的吸附常数最大((1.57±0.19)×104mol/(L·s)),其次为PS((1.26±0.10)×104mol/(L·s))。VhPLD对PG和PI的ka值分别为(3.72±0.12)×103mol/(L·s)和(3.49±0.35)×103mol/(L·s),均显著低于其他磷脂底物。然而,在20 mN/m条件下,VhPLD对于PE的解离常数((8.48±1.31)×10-3s-1)明显高于PC((3.80±1.40)×10-3s-1)和PS((4.26±0.97)×10-3s-1),该结果与在15 mN/m条件下结果有较大差异。VhPLD对于PG和PI的吸附平衡常数分别为(5.43±0.02)×106mol/L和(5.12±0.05)×106mol/L。该结果表明在初始表面压力20 mN/m条件下,酶对PG的亲和力最大,其次为PI,而对于PE的亲和力最小,吸附偏好性顺序依次为PG>PI>PC>PS>PE。
在初始表面压力为25 mN/m的条件下(见图4),VhPLD对PC的吸附常数最大((1.46±0.10)×104mol/(L·s)),对于PG((3.58±0.31)×103mol/(L·s))和PI((4.30±0.34)×103mol/(L·s))的吸附常数最小。在该初始表面压力条件下,VhPLD对于PC、PE和PS的解离常数之间不存在显著差异(P>0.05),该结果与在15 mN/m所测定的结果保持一致。而在该条件下获得的VhPLD对不同磷脂单分子层吸附偏好性顺序为PC>PS>PI>PE=PG。
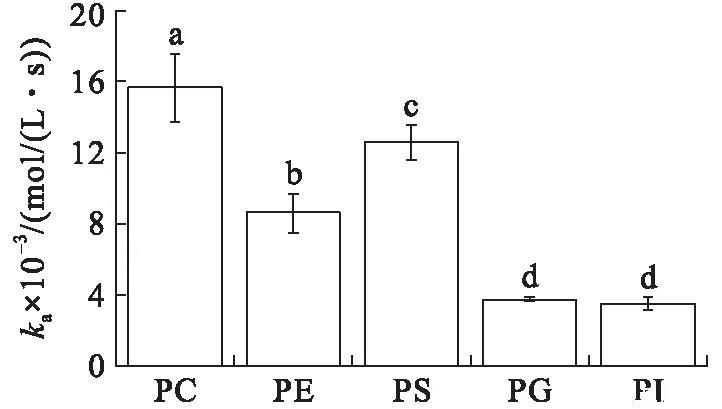
图3初始表面压力为20 mN/m的条件下VhPLD对PC、PE、PS、PG和PI的吸附动力学参数
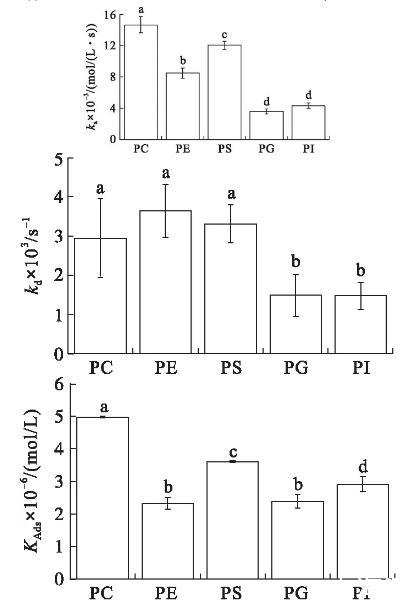
图4初始表面压力为25 mN/m的条件下VhPLD对PC、PE、PS、PG和PI的吸附动力学参数
2.2.2不同初始表面压力条件下VhPLD对单一磷脂的吸附动力学参数比较
相比于15 mN/m的初始表面压力条件,VhPLD在20 mN/m和25 mN/m条件下对PC、PE和PS的吸附常数均显著高于15 mN/m条件下相应的ka值(P<0.05),VhPLD在20 mN/m和25 mN/m条件下ka之间却没有显著性差异(P>0.05)。而对于PG而言,不同初始表面压力条件下ka之间没有显著性差异(P>0.05)。相反的,VhPLD在25 mN/m条件下PI的ka与在15 mN/m和20 mN/m条件下均有显著性差异(P<0.05)。
对于解离常数,除了在20 mN/m条件下对PE的kd值显著高于15 mN/m和25 mN/m条件下外,其他磷脂底物在不同初始表面压力下的kd值之间均没有显著性差异(P>0.05)。
不同初始表面压力条件对VhPLD的磷脂吸附亲和力具有较大的影响。对于PC及PS而言,亲和力随着表面压力的增加而逐渐增大,对于PE来说,其在20 mN/m条件下的亲和力要显著低于其他表面压力条件下的值,主要原因是由于在此表面压力条件下的kd值变大引起的。而对于PG和PI,最大的亲和力出现在20 mN/m条件下,主要是由于在此条件下酶的解离常数降低所导致。
3、结论
酶蛋白对于磷脂质-水界面的吸附动力学参数与磷脂单分子层的种类及不同初始表面压力状态密切相关。在15 mN/m条件下,VhPLD对不同磷脂单分子层吸附偏好性顺序为磷脂酰胆碱>磷脂酰甘油>磷脂酰丝氨酸>磷脂酰乙醇胺=磷脂酰肌醇;在20 mN/m条件下,VhPLD对不同磷脂单分子层吸附偏好性顺序为磷脂酰甘油>磷脂酰肌醇>磷脂酰胆碱>磷脂酰丝氨酸>磷脂酰乙醇胺;而在25 mN/m条件下,VhPLD对不同磷脂单分子层吸附偏好性顺序则转变为磷脂酰胆碱>磷脂酰丝氨酸>磷脂酰肌醇>磷脂酰乙醇胺=磷脂酰甘油。该结果提示在表征酶对不同磷脂吸附动力学参数的时候,必须要强调所处的表面压力条件,否则单纯评价对于不同磷脂的吸附动力学参数是没有意义的。










