摩登7平台合作客户/
拜耳公司 |
同济大学 |
联合大学 |
美国保洁 |
美国强生 |
瑞士罗氏 |
相关新闻Info
-
> 脱模剂配方中加入石油磺酸钠,可降低液体表面张力、减少界面形成
> 各种测量ILs汽化焓对比:表面张力法、热重法、简单相加法、 基团贡献法……(一)
> 10种常用表面活性剂水溶液的表面张力测定、泡沫的产生和测试(二)
> 水面上单分子层膜通过磷脂光控开关实现可逆光学控制——实验
> 表面能和表面张力关系,如何降低表面张力
> Delta-8 动物胃肠道体内中药物的溶解度的测定——结论、工具书类!
> 如何判断表面张力仪的好坏?
> 植物油中N-酰基氨基酸表面活性剂的界面活性和聚集行为——摘要、简介
> 影响狭缝间氢键流体气液平衡界面张力的因素有哪些(二)
> 一种新表面张力改性方法让全固态电池性能更优
推荐新闻Info
-
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(三)
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(二)
> 不同PQAI溶液静态/动态表面张力变化及对脉动热管性能影响(一)
> 界面流变仪可以测量液体表面张力吗?界面流变仪与界面张力仪区别解析
> 测量表面张力/界面张力的仪器有哪些?怎么选
> PG脱酰胺添加量对玉米醇溶蛋白气-水动态表面张力的影响
> 摩登7表面张力仪使用指南【专业版】
> 平面流动皂膜表面张力系数、厚度和流动速度实验装置及测量方法(二)
> 平面流动皂膜表面张力系数、厚度和流动速度实验装置及测量方法(一)
> 单层膜界面上亚微米颗粒表面张力阻力系数修正——颗粒在单层膜上的阻力系数
生物表面活性剂产生菌菌体密度、细胞疏水性与发酵液pH及表面张力的关系(二)
来源:大连工业大学学报 浏览 801 次 发布时间:2024-09-14
2结果与分析
2.1生物表面活性剂产生菌的筛选
经富集分离共得到49株细菌,初步筛选出14株生长较好的目的菌株接种于发酵培养基。在微生物采油过程中,表面活性剂和有机酸可以把原油从岩层中剥离下来,提高原油流动性。因此,以发酵过程中发酵液的pH和表面张力的降低为指标,对初筛得到的菌株进行复筛,同时分析所产生物表面活性剂的类型,结果见表1。
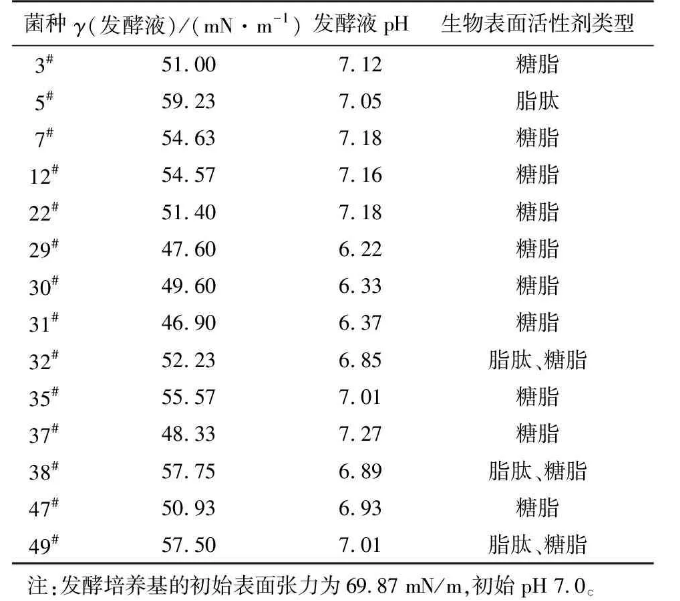
表1初筛菌株的发酵测定结果
由表1可知,菌株29#、30#、31#、37#、47#的发酵液的表面张力值及pH较低。选取该5株菌进行分析,菌株29#、30#、31#发酵液的表面张力及pH比较接近,产生的生物表面活性剂均为糖脂,在原油平板上的菌落均为荧光绿色,种子液和发酵液均为荧光绿色,细胞均为杆状且大小相同。因此,判断该3株菌为同一菌种。复筛得到的菌株为31#、37#、47#。
2.2生物表面活性剂产生菌的生理生化特性
对筛选所得菌株进行常规生理生化特性实验,结果如表2所示。根据表2所示结果和《伯杰氏(Berge)菌种鉴定手册》的描述,可鉴定菌株31#为假单孢属,菌株37#、47#均为芽孢杆菌属。

表2生物表面活性剂产生菌的生理生化特性
2.3生物表面活性剂产生菌的生长特性
2.3.1菌株31#的生长特性
菌株31#的生长特性如图1所示。在发酵前48 h,菌株31#细胞疏水性呈上升趋势,菌体密度逐步增长,发酵液的表面张力下降。表明较强的细胞疏水性能增加菌体对疏水性有机物的吸附,从而增加菌体与有机物的接触机会,增强对有机物的利用能力,导致菌体大量生长并产生大量的生物表面活性物质,使发酵液的表面张力大幅度下降,产生的生物表面活性物质通过改变吸附界面的特性来调节细胞与界面之间的亲和力,进一步促进微生物细胞对烃类化合物的附着和烃类化合物穿透细胞膜间隙。在发酵48~84 h期间,菌体生长进入衰亡期,细胞疏水性下降,发酵液的表面张力呈下降趋势,这是部分菌体自溶释放出细胞内的生物表面活性物质的结果。在发酵84~108 h期间,细胞疏水性呈下降趋势,发酵液的表面张力随菌体密度增大而增大,表明菌体摄取烃类化合物能力降低,利用发酵液中积累的生物表面活性剂呈现二次生长。在发酵108~120 h期间,细胞疏水性上升,表面张力下降。由于31#为革兰氏阴性菌,细胞外壁中存在与其疏水性密切相关的脂多糖,发酵液中大量积累的生物表面活性剂导致细胞壁中脂多糖大量流失,从而引起细胞疏水性增大。
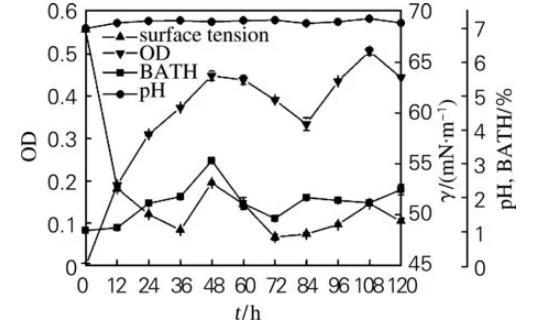
图1菌株31#的好氧培养过程曲线
2.3.2菌株37#的生长特性
菌株37#的生长特性如图2所示。在发酵过程中,细胞疏水性总体呈上升趋势。发酵24 h时,细胞疏水性大于1,菌体密度随细胞疏水性的增大而增大。发酵36 h时,发酵液的表面张力降低,这是因为烃类的难溶性使得微生物在摄取烃类生长过程中往往伴随着生物表面活性剂的生成,其主要作用是使烃类在水溶液中有效扩散,并渗入细胞内部被同化分解,菌体能够更好地利用烃类碳源生长,菌体密度上升。在发酵48~84 h期间,菌体生长进入稳定期,菌体密度保持不变。在发酵84~96 h期间,菌体密度上升,细胞出现二次生长。这是由于液体石蜡是一种混合物,菌体首先摄取较易利用的10个碳以上的长链烷烃,然后再利用其他链长的烷烃进行生长,同时因为细胞疏水性上升,细胞利用液体石蜡的能力增强,从而产生大量的生物表面活性物质,使发酵液的表面张力下降。在发酵96~120 h期间,细胞疏水性的降低,菌体密度降低,菌体生长进入衰亡期,发酵液的表面张力上升。
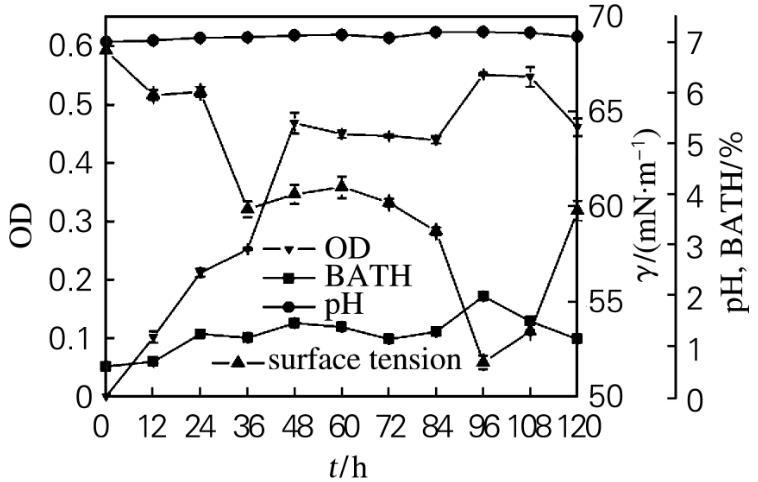
图2菌株37#的好氧培养过程曲线
2.3.3菌株47#的生长特性
菌株47#的生长特性如图3所示。在发酵前48 h,菌体密度显著增长,细胞疏水性增大,发酵液的表面张力降低。在发酵60~72 h期间,菌体密度减小,细胞疏水性降低,发酵液表面张力降低,菌体生长进入衰亡期。在发酵72~84 h期间,菌体密度增加,细胞出现二次生长,产生大量的生物表面活性物质,使发酵液的表面张力大幅下降。在发酵84~120 h期间,菌体密度降低,发酵液的表面张力在保持一段时间的基本稳定后升高。表明菌体在利用烃类生长过程中,产生了生物表面活性剂。生物表面活性剂的产生降低了油水界面张力,使烷烃得以有效扩散,增大油水界面面积,从而便于细胞与较大油滴之间的直接接触,同时使细胞的疏水性变大,导致细胞亲油,从而有利于菌对烃类的利用。
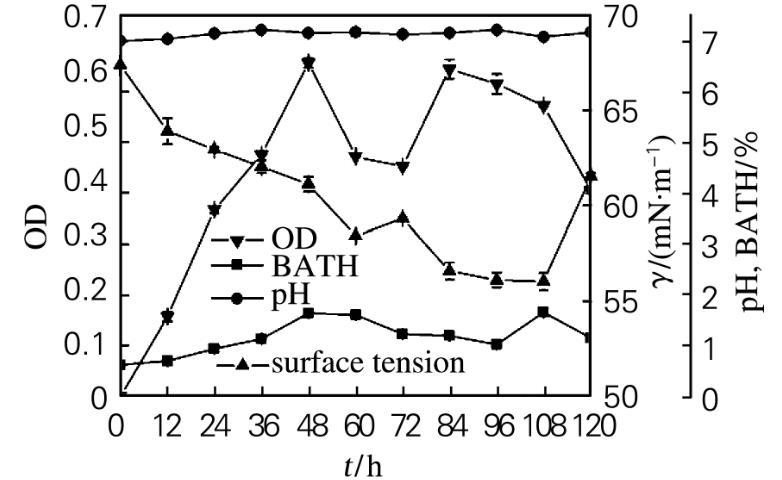
图3菌株47#的好氧培养过程曲线
2.4生物表面活性剂的化学组分分析
将菌株31#、37#和47#于30℃培养后,对发酵液萃取所得生物表面活性剂粗制品进行硅胶薄层层析,结果如图4所示。将萃取所得生物表面活性剂粗制品进行酸解,硅胶薄层层析结果如图5所示。
图4的层析结果显棕色,说明菌株31#、37#和47#所产的生物表面活性剂均为糖脂。由图5可知,菌株31#、37#和47#所产的生物表面活性剂经酸解后显棕色斑点,且Rf值与鼠李糖的Rf值相同,说明菌株31#、37#和47#所产的生物表面活性剂的糖基均为鼠李糖。

图4生物表面活性剂粗品的TLC图谱
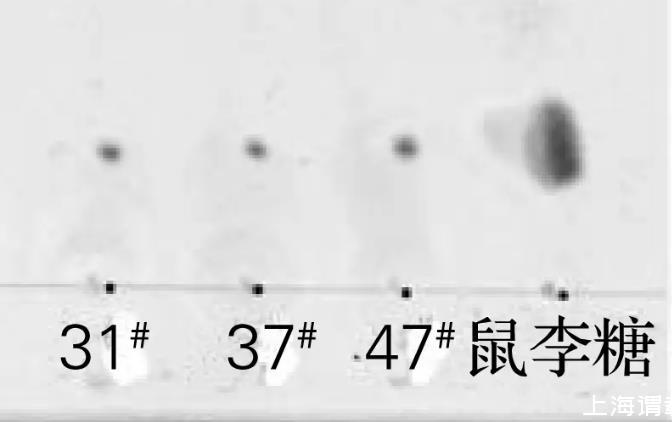
图5生物表面活性剂酸解后的TLC图谱
3结论
通过对发酵液表面张力及pH的测定,筛选出3株生物表面活性剂产生菌,且所产的生物表面活性剂均为鼠李糖脂;经生理生化鉴定,菌株31#为假单胞菌属,菌株37#、47#为芽孢杆菌属;通过对所筛菌株的生长特性的研究,说明菌体密度、细胞疏水性、发酵液的pH及表面张力之间密切相关,相互制约。在以液体石蜡为唯一碳源培养时,菌株31#的发酵液表面张力下降最多,且表现出的细胞疏水性最强,发酵液表面张力下降到49.47 mN/m,细胞疏水性为3.09%。较强的细胞疏水性有利于菌体对疏水性基质的利用,从而导致菌体密度的增长及发酵液表面张力的下降,这对微生物开采稠油十分有利。










